实验一 荧光物质稀溶液的激发、发射和同步荧光光谱测定
一. 实验目的
1.学习荧光分析法的基本原理和LS-55B发光分析仪的操作。
2.学习同步荧光的操作,了解同步荧光的优点。
二. 实验原理
荧光是分子从激发态的最低振动能级回到原来基态时发射的光。利用物质被光照射后产生的荧光辐射对该物质进行定性分析和定量分析的方法,称为荧光分析。
在一定光源强度下,若保持激发波长
 不变,扫描得到的荧光强度与发射波长
不变,扫描得到的荧光强度与发射波长
 的关系曲线,称为荧光发射光谱;反之,保持
的关系曲线,称为荧光发射光谱;反之,保持
 不变,扫描得到的荧光强度与
不变,扫描得到的荧光强度与
 的关系曲线,则称为荧光激发光谱。在一定条件下,荧光强度与物质浓度成正比,这是荧光定量分析的基础。荧光分析的灵敏度不仅与溶液的浓度有关,而且与紫外光照射强度及所选测量波长等因素有关。
的关系曲线,则称为荧光激发光谱。在一定条件下,荧光强度与物质浓度成正比,这是荧光定量分析的基础。荧光分析的灵敏度不仅与溶液的浓度有关,而且与紫外光照射强度及所选测量波长等因素有关。
苯酚由于其共轭结构,有荧光活性,可以用荧光分析法测定。它们的激发光谱和发射光谱有互相重叠的现象。对于复杂组分,当激发光谱和发射光谱有互相重叠的现象时,可以用同步荧光扫描,同步扫描荧光光谱技术可以简化、窄化光谱,提高选择性。
三. 实验仪器和试剂
1. LS-55型发光谱仪;
2. 移液枪(德国BRAND公司生产);
3. 50ml容量瓶,25ml容量瓶10支;
4. 苯酚储备液:960mg/L
5. 去离子水;
四. 实验内容
1.预扫描(pre-scan)
用储备液配制浓度为10ppm(mol/L)的工作液,设定仪器参数,进行全波长预扫描,并记录扫描结果,得出最大激发和发射波长,同时查看其瑞利散射波长、以及双倍频峰波长。
2.激发光谱、发射光谱和同步荧光扫描
①设定合适的参数,分别对苯酚溶液进行荧光激发、发射和同步荧光光谱扫描。
②取浓度为0.010(mol/L)的工作液,扫描发射光谱,加水稀释后再在同样波长下扫描发射光谱,观察荧光猝灭效应。
发射光谱参数:扫描波长范围200—750nm;Ex=214nm、270nm,扫描速度=1000 nm/min, Ex-Slit=10nm, Em-slit=5nm,,记住取文件名。
激发光谱参数:扫描波长范围200-750nm,
 =300nm、586nm,扫描速度=1000nm/min, Ex-Slit=10nm, Em-slit=5nm,记录信息。
=300nm、586nm,扫描速度=1000nm/min, Ex-Slit=10nm, Em-slit=5nm,记录信息。
同步荧光光谱:扫描波长范围250-750nm, Δλ(
 -
-
 )=30nm、86nm,扫描速度=1000nm/min, Ex-Slit=10nm, Em-slit=5nm,记录信息。
)=30nm、86nm,扫描速度=1000nm/min, Ex-Slit=10nm, Em-slit=5nm,记录信息。
3.三维荧光光谱扫描
设定发射波长范围,激发开始波长,步长,测定数目,开始进行苯酚三维荧光光谱扫描。
五.数据处理
1.用实验获得的数据绘制苯酚的激发、发射、同步光谱。
2.对比不同浓度下的苯酚的最大激发波长和最大发射波长处的峰高,了解荧光猝灭效应。
取浓度为0.01(mol/L)的苯酚溶液,固定激发光的波长为270nm,狭缝宽度为10.0nm,发射光的狭缝宽度为5.0nm,扫描波长范围250—750nm,扫速为1000nm/min,扫描荧光强度与发射光波长的关系曲线,所得曲线如下:
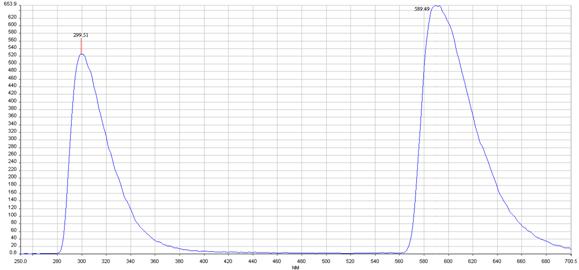
图7
将溶液稀释后再以同样的条件扫描荧光强度与发射光波长的关系曲线,所得曲线如下:
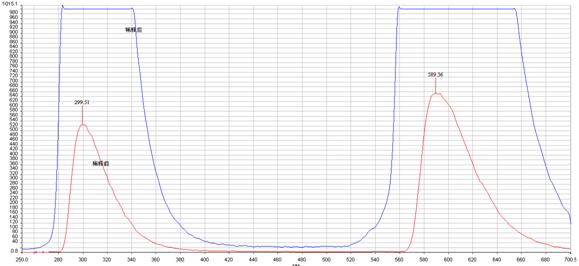
图8
从图7与图8(图8中红色线是稀释前的曲线,蓝色线是稀释后的曲线)上可明显看出稀释后的峰的强度大了许多,这是由于在高浓度时一部分苯酚的发射光被自身吸收了,发生了荧光的猝灭,而浓度低时这种自身吸就大大减少,峰的强度反而变大。所以,荧光分析的浓度不能高。
3.用MATLAB绘制三维荧光光谱。
六.讨论与思考
1.对待测溶液进行预扫描的有何作用?
2.观察激发光波长的整数倍处荧光发射光谱在有何特点?该波长是否适合于进行定量分析?
3.同步荧光技术有哪些优点?比较激发、发射和同步荧光光谱中的峰值及对应波长,比较他们的不同,并解释原因。
4.比较紫外分光光度法和荧光分析法的区别和各自的优缺点。
实验二 有机化合物红外光谱的测定
一.实验目的
通过红外吸收光谱的测定,掌握Nicolet FT-IR的使用方法。
二.实验原理
本实验用Nicolet FT-IR测定有机物以及高分子的红外吸收光谱。
红外光谱作为“分子的指纹”广泛用于分子结构和物质化学组成的研究。根据分子对红外光吸收后得到谱带频率的位置、强度、形状以及吸收谱带和温度、聚集状态等的关系便可确定分子的空间构型,求出化学键的力常数、键长和键角。从光谱分析的角度看主要是利用特征吸收谱带的频率推断分子中存在某一基团或键,由特征吸收谱带频率的变化推测临近的基团或键,进而确定分子的化学结构,当然也可由特征吸收谱带强度的改变对混合物及化合物进行定量分析。
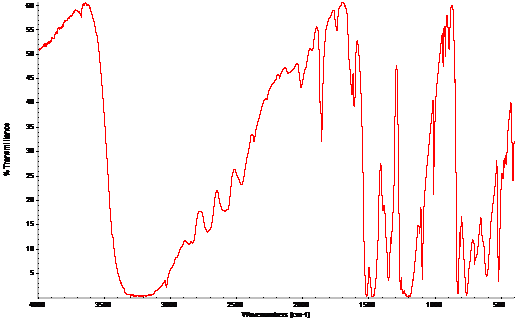
对苯二酚的红外吸收谱图如上,可以看到在3500cm-1处有个大的吸收峰,这是羟基的吸收峰,3000 cm-1左右是C-H的吸收峰,1500 cm-1是C=C的吸收峰。
三.实验仪器和试剂
6. Nicolet FT-IR傅立叶红外光谱仪(美国热电公司, Thermo);
7. 压片机(美国热电公司);
8. 多功能反射头(美国热电公司)
9. 对苯二酚
10.聚苯乙烯薄膜;
11. 自备样品(塑料);
12.KBr固体
四.实验内容
13.
 空气中CO2的测定
空气中CO2的测定
(1)实验步骤:
不放样品的情况下测试空气中的红外吸收谱图,在不扣除背景的情况下在nm下可以看到CO2的红外吸收谱图,在分辨率为4cm-1和1cm-1两种情况下分别测试。
(2)分析两种分辨率下的谱图的异同。观察CO2的红外吸收精细结构。
14.
15.维生素C的测定
(1)压片:将少量维生素C固体加入到KBr粉末中,碾碎并拌匀,用压片机压成薄片。
(2)测试:将压好的样品薄片放置在红外光谱仪中,测定样品的红外吸收光谱,需要扣除背景。
(3)谱图解析:将测得的谱图在谱图库中查询比对,看看是不是自己测得的物质,并记录匹配度;分析谱图,将各种官能团指出来。
16.聚苯乙烯薄膜的测定
(1)测试:将聚苯乙烯薄膜放置在红外光谱仪中,测定样品的红外吸收光谱,需要扣除背景。
(3)谱图解析:将测得的谱图在谱图库中查询比对,看看是不是自己测得的物质,并记录匹配度;分析谱图,将各种官能团指出来。
17.自备样品(透明塑料薄膜)的测定
(1)红外吸收谱图的测定:
测试:将自备塑料样品放置在红外光谱仪中,测定样品的红外吸收光谱,需要扣除背景。
谱图解析:将测得的谱图在谱图库中查询比对,看看自己测得的是何种物质,并记录匹配度;分析谱图,将各种官能团指出来。
实验三 多元校正-分光光度法同时测定混合色素
一. 目的
1. 了解矢量数据的获取方法及其在多组分测定中的应用。
2. 了解计算机技术及化学计量学基本方法在波谱解析中的应用。
二. 原理
食用合成色素是饮料等食品中的常用添加剂,但合成色素具有一定的毒性,过量使用有害健康。因此,色素的分析对食品工业具有重要意义。由于色素对可见光有较强吸收,故分光光度法是测定色素的基本方法。但当有多种色素同时存在时,通常要借助薄层层析等方法使各组分分离后,才能进行定量测定。这使得测定步骤十分烦琐。化学计量学方法为混合色素不经分离进行准确地同时测定提供了可能。
设有nc个组分同时存在,配制一组已知样本共ns个溶液,其浓度矩阵为Cnc×ns,在nw个波长下测得吸光度矩阵Anw×ns。根据朗伯—比耳定律有:
 (1)
(1)
其中Knw×nc为吸光度矩阵,根据最小二乘法原理可求出各组分的纯物种谱,即K矩阵:
 (2)
(2)
式(2)中t和-1分别表示该矩阵的转置和逆。对于一个或一组未知样,同样在nw个相同波长下测定后,可用最小二乘法根据下式求出未知物的浓度。
 (3)
(3)
三. 仪器与试剂
1. 仪器
722分光光度仪、Agilent8453UV-VIS分光光度仪
容量瓶:50ml 6个 移液管:5ml 4支
2. 试剂
2.1 胭脂红溶液(120mg/L):称取0.120g胭脂红用纯水溶解后定容至1L。
2.2 柠檬黄溶液(100mg/L):配制方法参考2.1。
2.3 日落黄溶液(100mg/L):配制方法参考2.1。
2.4 HCl(0.1 mol/L):量取16.6mL盐酸(A.R.)用纯水定容至2000mL。
四. 实验部分
1. 混合色素的测定
要求同学根据下列提示,自己设计实验步骤,并测定三份未知混合样。
1.1 测定食用色素的吸光度,必须控制pH值,建议控制酸度为 CHCl=0.01mol L-1(pH=2.0)。
1.2 在酸性条件下,三种色素的最大吸收波长和吸光系数的参考值如下:
|
胭脂红 |
日落黄 |
柠檬黄 |
λmax/nm |
510 |
480 |
400 |
K/(L g-1 cm-1) |
20 |
31 |
33 |
1.3 标准溶液建议配制6份。每份溶液中各组分的含量应线性不相关,所测得吸光度值0.1~1为宜。具体步骤为:分别吸三种色素储备液若干毫升,加入5.0mL 0.10 mol L-1的HCl,定容至50mL。每次标准溶液的吸取量填入表1。
表1. 标准溶液的组成(即C矩阵)
样品号 |
1 |
2 |
3 |
4 |
5 |
6 |
胭脂红 |
|
|
|
|
|
|
日落黄 |
|
|
|
|
|
|
柠檬黄 |
|
|
|
|
|
|
2. 模拟实验:
吸收光谱通常用洛仑兹函数来模拟,当第j个组分存在时,吸光度的计算公式如下:
 (4)
(4)
式中λ0,j : 第j组分的最大吸收波长; λi : 第i 个波长;
kmax,j : 波长为λ0时的吸光系数,即最大吸光系数;
cj: 第j个组分的含量(g/L);
bj: 调节峰宽的参数;b值越大,峰越窄。
当三组分同时存在时,则有:
 (5)
(5)
AE为测量误差。产生AE的方法如下:
2.1 随机误差法:AE=(0.5-random)×D
Random 为0~1间的随机数,D为吸光度的随机波动范围,取D=0.004较合适。
2.2 Monto Carlo法:
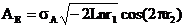
r1、r2为0~1间的随机数。该方法获得的误差符合正态分布N(0,σ2 ),标准差σA取0.002~0.003较合适。
2.3 真实误差法:在(2)法的基础上,考虑到吸光度A的标准偏差随A的增大而增大,但透光率的标准差一般为常数,两者关系为
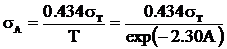
可取σT=0.002。根据以上方法,可获得标准样本集和未知样本集的吸光度矩阵。
五. 数据处理
根据原理部分提出的数据处理方法,用自己擅长的计算机语言编程,求出K矩阵并预报未知样。
利用实验室提供的软件:multicom.exe ,该程序用Delphi7.0编写,在Windows下运行。界面如图1。输入相应的数据后,可保存数据文件,并进行未知样预报、因子分析及交叉验证等运算。运算结果应在实验报告中给出。

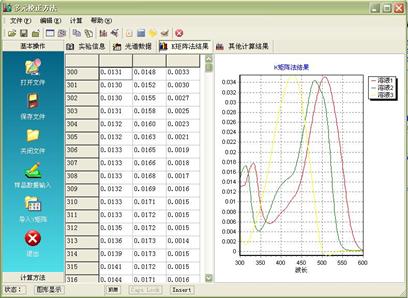
图1 数据处理程序主菜单
六. 讨论题:
1. 从理论上讲,任取三个波长测定后解联立方程,也能获得结果。问:多波长测定后并利用多元校正方法求解有什么优点?
2. 根据各组分的吸收光谱,找出最大吸收波长及相应的吸光系数。
3. 如果要用本实验提供的方法,测定市售欲测定其中色素的含量,试分析在什么条件下能获得较可靠的结果?
4. 查出有关合成色素测定的参考文献并列于实验报告中。
七. 解决实际问题
通过文献查阅,设计一种测定市售饮料中色素含量的方法并用于美年达中日落黄的测定。
实验四 无机盐晶体及水溶液的拉曼光谱检测
一. 实验目的
1、了解拉曼光谱的基本原理,掌握显微共焦激光拉曼光谱仪的使用方法。
2、测量一些常规物质和复杂样品的拉曼光谱。
二. 实验原理
当用波长比试样粒径小得多的频率为υ的单色光照射气体、液体或透明试样时,大部分的光会按原来的方向透射,而一小部分则按不同的角度散射开来,产生散射光。散射光中除了存在入射光频率υ外,还观察到频率为υ±△υ的新成分,这种频率发生改变的现象就被称为拉曼效应。υ即为瑞利散射,频率υ+△υ称为拉曼散射的斯托克斯线,频率为υ-△υ的称为反斯托克斯线。△υ通常称为拉曼频移,多用散射光波长的倒数表示,计算公式为

式中,λ和λ0分别为散射光和入射光的波长。△υ的单位为cm-1。
由于拉曼谱线的数目、频移、强度直接与分子振动或转动能级有关。因此,研究拉曼光谱可以提供物质结构的有关信息。自从激光问世以来,拉曼光谱的研究取得了长足进展,已广泛应用于物理、化学、生物以及生命科学等研究领域。
图1显微共焦激光拉曼光谱仪结构
三. 实验仪器和试剂
1. 显微共焦激光拉曼光谱仪 Renishaw inVia(英国雷尼绍公司)
2. 粉碎机、载玻片、盖玻片、胶头滴管
3. 测试样品
常规物质:CCl4,CH2Cl2
复杂样品:不同淀粉类作物
自备样品:不同材料的小挂件
四. 实验步骤
1.打开主机和计算机电源,同时打开激光器后面的总电源开关,将仪器预热20分钟左右。
2. 自检.
静态取谱(Static),中心520 Raman Shift cm-1, Advanced -> Pinhole 设为 in。使用硅片,用50倍物镜,1 秒曝光时间,100%激光功率取谱。使用曲线拟合(Curve fit)命令检查峰位,检验仪器状态。
3.样品拉曼光谱的测定
将样品放置在载玻片上,盖上盖玻片,置于显微镜的载物台上,调节显微镜载物台的高度使得显微镜能够清晰地观察到样品表面(上2,下1)。选择Measurement->New->Spectral acquisition进行实验条件设置,再将白光照明光路切换到激光照明光路(上1,下2),即选择激光照射,选择Measurement->Run运行实验,等待实验运行,直到窗口中出现红色的光谱曲线,采集光谱结束,保存扫描结果。
4.分别测定CCl4、大米、自备物品的拉曼光谱图。
五.数据处理
用仪器自带软件WiRE2.0或Excel绘制拉曼光谱。纵坐标是散射强度,可用任何单位表示,横坐标是拉曼位移,通常用相对于瑞利线的位移表示其数值,单位为波数cm-1。
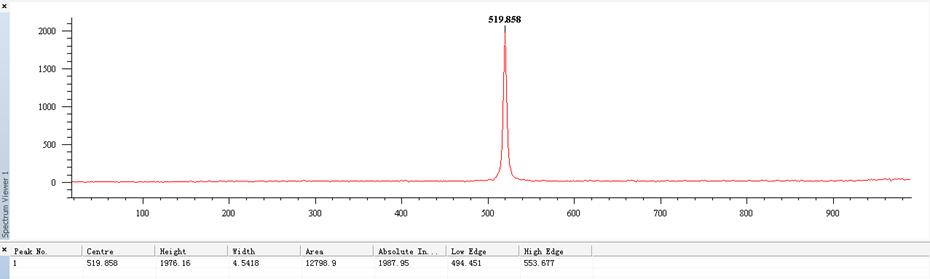
1.纯物质的拉曼光谱
(1)标定所用的单晶硅的Stokes线的拉曼光谱图:
(2)CCl4的拉曼光谱图
①Stokes线和Anti-Stokes全扫描的拉曼光谱图:
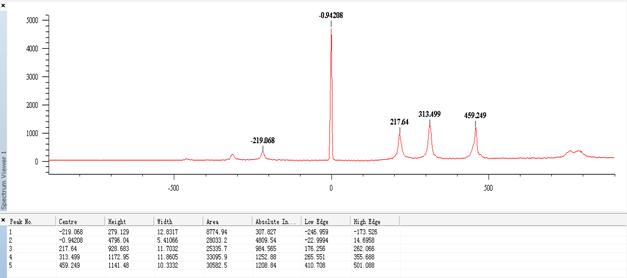
②只有Stokes线的拉曼光谱图:
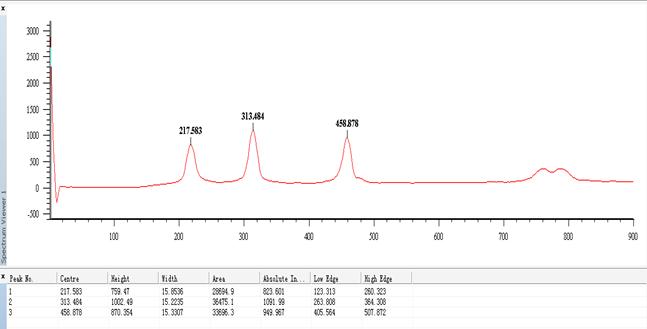
(3)CH2Cl2的拉曼光谱图

图2 CH2Cl2的拉曼光谱图
2.不同淀粉类作物的拉曼光谱
3.其他物品的拉曼光谱
六. 讨论与思考:
1.比较红外光谱与拉曼光谱的异同。
2. 一般的拉曼散射有斯托克斯线和反斯托克斯线两种,为什么实验中记录的拉曼光谱常取斯托克斯线?
3. 试分析常规物质(CCl4、CH2Cl2)的特征拉曼光谱。
4.拉曼光谱的发展及应用。
实验五 铁氰化钾循环伏安法有关性质的测定
一. 实验目的
掌握循环伏安法(CV)基本操作;掌握受扩散控制电化学过程的判别方法;了解可逆电化学过程及条件电极电位的测定;了解电化学—化学偶联反应过程的循环伏安特点。并学会电化学工作站仪器的使用。
二. 循环伏安法原理
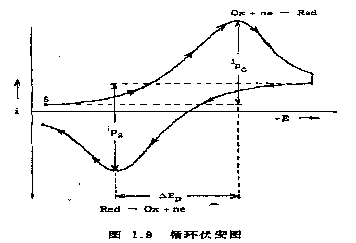
扫描电压呈等腰三角形。如果前半部扫描(电压上升部分)为去极化剂在电极上被还原的阴极过程,则后半部扫描(电压下降部分)为还原产物重新被氧化的阳极过程。因此.一次三角波扫描完成一个还原过程和氧化过程的循环,故称为循环伏安法。循环伏安法可用于研究化合物电极过程的机理、双电层、吸附现象和电极反应动力学.成为最有用的电化学方法之一
三. 实验步骤
1. 电极表面抛光
2. 验证:亚铁氰化钾溶液中进行循环伏安扫描(电位差小于70mv)
3. 电极连接,参数设定(起始电位、电位扫描范围、扫描速度等)
4. 测定:峰电流随电位扫描速度的变化(处理在一张图上)
5. 反应模拟器(Simulation):模拟实验(调节:模型、传递系数α、标准速率常数k0等)
四. 数据处理
计算亚铁氰化钾的条件电极电位;
作出峰电流~扫速v 1/2图,判断是否是扩散控制过程。
实验六 全自动电位滴定法测定混合酸
1 实验目的
(1)初步了解和掌握自动电位滴定仪的原理和操作;
(2)掌握多元酸或混合酸分步滴定的有关规律;
(3)用NaOH溶液滴定由HCl与H3PO4组成的混合溶液,分别测出这两种酸的浓度。
2 实验仪器和试剂
2.1 实验仪器
798MPT(或702SM)自动电位滴定仪,氢离子选择性复合电极(滴定仪和电极均由瑞士万通公司生产)。
100mL烧杯,100mL量筒,10mL(或5mL)移液管,洗耳球。
2.2 实验试剂
0.1000mol/L NaOH标准溶液(已用基准邻苯二甲酸氢钾标定);由HCl与H3PO4组成的待测混合溶液。
3 实验原理和步骤
3.1 实验原理
由于HCl 是强酸,H3PO4的pKa1、pKa2及pKa3分别为2.12、7.20及12.36,用NaOH溶液滴定由HCl与H3PO4组成的混合溶液,滴定曲线有两个突跃。第一个突跃对应的NaOH溶液的体积记作V1,相应的滴定产物是H2O和H2PO4-,滴定反应是
H++ OH- = H2O (1)
和
H3PO4+ OH- = H2PO4- (2)
第二个突跃对应的NaOH溶液的体积记作V2,相应的滴定产物是HPO42-,滴定反应是
H2PO4-+ OH- = HPO42- (3)
在上述滴定中,V2 -V1是滴定H2PO4- 所消耗的NaOH溶液的体积(见反应(3)),也是滴定H3PO4所消耗的NaOH溶液的体积(见反应(2));V1 -(V2 - V1)= 2V1 - V2 是滴定HCl所消耗的NaOH溶液的体积(见反应(1))。因此,利用上述两个突跃对应的滴定终点V2和 V1 ,按以下两式,可以分别求出混合溶液中HCl和H3PO4的浓度:
 (4)
(4)
 (5)
(5)
3.2 实验步骤
实验步骤:在100mL烧杯中,用移液管吸入5.00mL HCl和H3PO4混合溶液,加50mL H2O,加入搅拌子,放好电极,用0.1000mol/L NaOH标准溶液电位滴定。仪器自动记录滴定曲线和滴定数据,并测出滴定终点V1和V2。
仪器的设置:选择Met(等体积)滴定模式,滴定步长0.10mL,平衡时间30s,滴定至加入的标准溶液体积为10.00mL。
4 实验结果和讨论
(1)滴定曲线(附图);
(2)测定结果(附表,见下表);
(3)有关实验现象的讨论。
表1 HCl和H3PO4混合溶液的测定结果
V1/mL |
V2/mL |
混合溶液中HCl的浓度/(mol·L-1) |
混合溶液中H3PO4的浓度/(mol·L-1) |
|
|
|
|
5 思考题
(1)多元酸(二元酸或三元酸)分步滴定的条件是什么?混合酸(如由HCl与H3PO4组成的混合酸)分步滴定的条件是什么?
(2)电位滴定法确定滴定终点有哪些方法?这些方法的依据是什么?
(3)自动电位滴定仪确定滴定终点的依据是什么?
(4)本实验所用的氢离子选择性复合电极的构造和原理是怎样的?
(5)在本实验的滴定过程中,若存在CO2的干扰,对测定结果有什么影响?
实验七 高效液相色谱(HPLC)法测定邻苯二甲酸酯
一. 实验目的
1、学习高效液相色谱仪的基本操作方法。
2、了解高效液相色谱法在药物分析中的应用。
二. 实验原理
高效液相色谱法是以液体作为流动相,借助于高压输液泵获得相对较高流速的液流以提高分离速度、并采用颗粒极细的高效固定相制成的色谱柱进行分离和分析的一种色谱方法。
在高效液相色谱中,若采用非极性固定相,如十八烷基键合相,极性流动相,即构成反相色谱分离系统。反之,则称为正相色谱分离系统。反相色谱系统所使用的流动相成本较低,应用也更为广泛。
HPLC分析所用的色谱柱在出厂时都有关于其柱效的报告说明,以便购买者对照检验柱子的效能是否符合标准,也是鉴定该柱使用一段时间后其效能是否变化的参考标准之一。
下面是Agilent公司关于ZORBAX Eclipse XDB-C8 4.6×150mm,5µm型号柱的柱效能报告:
1.测试条件
流动相 :80%甲醇/20%纯水
柱压 :79.3 Bar
柱流速 :1.00ml/min
线性流速 :0.164cm/sec
温度 :室温(常温23℃)
注入体积:5µl
2.柱效测试报告
附表1 ZORBAX Eclipse XDB-C8 4.6×150mm,5µm型号柱测试条件
出峰次序 |
样品组成 |
浓度(µg/ml) |
保留时间(min) |
1 |
尿嘧啶 |
5 |
1.517 |
2 |
苯酚 |
200 |
1.876 |
3 |
4-氯硝基苯 |
25 |
2.481 |
4 |
甲苯 |
850 |
3.069 |
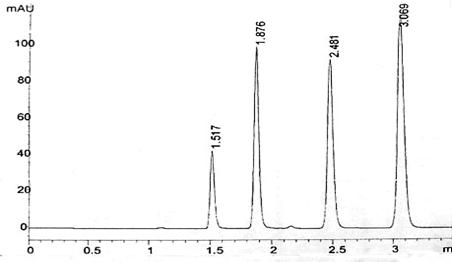
附图1混合物质分离色谱图(检测波长254nm)
如果要进行柱效检测,可按表1配制几种物质的混合溶液,在相同条件下进行HPLC分离检测,检验柱效。
三.仪器与试剂
1、仪器
Agilent 1100高效液相色谱仪,50ul微量注射器。
2、试剂
甲醇(色谱专用),高纯水
四. 实验步骤
1、色谱条件
色谱柱:辛烷基硅烷键合硅胶(C8)
柱温:室温
流动相:高纯水:30%,甲醇:70%
检测器:DAD检测器;
检测波长:220nm;
进样体积:20µl定量环,实际注射每次可控制在50µl。
2、待测溶液的配制
3、色谱测定
(1) 按操作规程开启电脑,开启脱气机、泵、检测器等的电源,启动Agilent 1100在线工作软件,设定操作条件。流量为1.000ml/min。
(2) 待仪器稳定后,开始进样。将进样阀柄置于“LOAD”位置,用微量注射器吸取混合物溶液50ul,注入仪器进样口,顺时针方向扳动进样阀至“INJECT”位置,此时显示屏显示进样标志。
(3) 记下各组分色谱峰的保留时间及峰面积。
(4) 实验完毕,清洗系统及色谱柱。依次用乙腈-水(5:95)、乙腈-水(50:50)、纯乙腈作流动相清洗,每次清洗至基线走稳,至少清洗15min。
五.实验结果
1.当流动相的比例为:高纯水:30%,甲醇:70%时,在254nm波长处得到的色谱图如下:
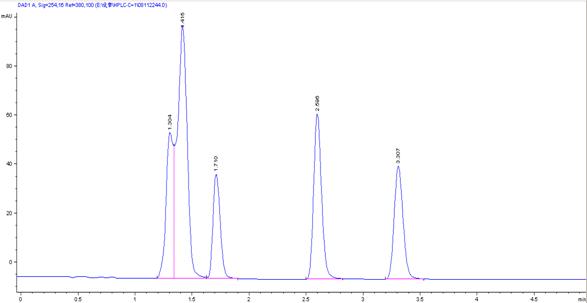
从图上可明显看出第一个峰是由两个峰叠加而成,因为尿嘧啶微溶于冷水,易溶于热水,在配制溶液时对其进行了加热,可能在加热时温度太高,尿嘧啶发生了水解,所以在尿嘧啶出峰处出现了另一个峰。
为了将这两个峰分开,对流动相的比例进行了调整,如2与3所示:
2.当流动相的比例为:高纯水:40%,甲醇:60%时,检测254nm波长处的色谱图。
3.当流动相的比例为:高纯水:50%,甲醇:50%时,得到在254nm波长处的色谱图。
六. 思考题
1. 比较图2和图3可知,在缓冲液作流动相的情况下,实验得出的峰形较好。但为什么实验室尽量不用缓冲溶液作流动相?
2. 流动相在使用前为什么要用砂芯漏斗过滤?
3. 清洗柱子时,为什么要如上述所述一步步清洗?
4. 如果增大流动相中乙腈的比例,有关组分的保留时间有何变化?
实验八 气相色谱-质谱(GC-MS)法对苯系物的分离分析
一. 实验目的
(1)了解气相色谱-质谱联用仪的基本构造,熟悉工作站软件的使用;
(2)了解运用GC-MS仪分析简单样品的基本过程。
二. 实验原理
气相色谱法是利用不同物质在固定相和流动相中的分配系数不同,使不同化合物从色谱柱流出的时间不同,达到分离化合物的目的。质谱法是利用带电粒子在磁场或电场中的运动规律,按其质荷比(m/z)实现分离分析,测定离子质量及强度分布。它可以给出化合物的分子量、元素组成、分子式和分子结构信息,具有定性专属性、灵敏度高、检测快速等特点。
气相色谱-质谱联用仪兼备了色谱的高分离能力和质谱的强定性能力,可以把气相色谱理解为质谱的进样系统,把质谱理解为气相色谱的检测器。气相色谱-质谱联用仪的基本构成为:

本实验中待分析样品为苯系物,各组成物质的沸点见表1.混合样品经GC分离成一个一个单一组份,并进入离子源,在离子源样品分子被电离成离子,离子经过质量分析器之后即按m/z顺序排列成谱。经检测器检测后得到质谱,计算机采集并储存质谱,经过适当处理可得到样品的色谱图、质谱图等。
表1 甲醇和苯系物沸点
|
甲醇 |
苯 |
甲苯 |
二甲苯 |
沸点(℃) |
64.8 |
80 |
110.8 |
144 |
三. 仪器和试剂:
(1)Agilent 6890-5973N GC-MS仪(安捷伦科技有限公司);
(2)HP-5 MS 色谱柱;
(3)0-5mL移液器 (Transferpette, 德国BRAND 公司);
(4)0.45μm的有机相微孔膜过滤器;
(5)苯、甲苯、二甲苯(分析纯),甲醇(色谱纯);
(6)容量瓶
四. 实验内容与步骤:
1)分别用移液器取1ml苯、甲苯、二甲苯混合后,用甲醇稀释1000倍后待用;
2)用移液器取2ml稀释液,使用0.45μm的有机相微孔膜过滤器后,转移至标准样品瓶中待测;
3)设定好GC-MS操作参数后,可进样分析:
4)设置样品信息及数据文件保存路径后,按下“Start run”键,待“Pre-run”结束,系统提示可以进样时,使用10μl进样针准确吸取1μl样品溶液(不能有气泡)。将进样针插入进样口底部,快速推出溶液并迅速拔出进样针,然后按下色谱仪操作面板上的“start”按钮,分析开始。
五. 色谱条件
进样口温度:250℃; 质谱离子源温度:230℃;
色质传输线温度:250℃; 质谱四极杆温度:150℃;
柱温:
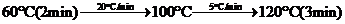
载气流速: 1.2ml·min-1;
进样量:1μl; 分流比:10:1。
溶剂延迟:1.5分钟
六. 数据处理
1) 对得到的总离子流色谱图(TIC),在不同保留时间处双击鼠标右键得相应的质谱图;
2) 在质谱图中,双击鼠标右键,得到相应的匹配物质,根据匹配度可对各峰定性;
3) 列出所有的物质,并结合其他知识确定各峰所对应的具体物质名称;
4) 绘制样品的总离子流色谱图,给出色谱峰定性结果(含质谱检索结果、物质名称、保留时间)
5) SIM模式下得到的色谱图。
七. 思考题
1.GC-MS仪是如何得到总离子流色谱的?除此之外,使用GC-MSD,我们还能获得哪几种色谱图,它们各有什么特点?
2.绘制某一保留时间处苯、甲苯的质谱图,分析它们主要产生了哪些离子峰。查阅质谱电离过程中分子碎裂的机理,写出苯、甲苯可能的分子碎裂过程。
3.解释:溶剂延迟(Solvent Delay)、分流比。
4.气相色谱适用于分析哪些样品,请举例说明。
注意事项
2)清洗容量瓶、标准样品瓶时不要使用清洁剂;
3)如果是一天的第一个样,请先把仪器跑一个空针;
4)待测样一定要经过微孔过滤膜过滤;
5)进样时不能有气泡;
6)进样时要快,不要使进样针在进样口里停留太久。
实验九 火焰原子吸收法测定自来水中的镁
一. 实验目的
1、掌握原子吸收分光光度法的基本原理
2、了解原子吸收分光光度计的主要结构,学习其操作方法。
3、学习干扰抑制剂的应用,及标准曲线的定量方法。
二. 实验原理
原子吸收分光光度法是利用被测元素的基态原子对特征辐射线的吸收程度来确定试样中元素含量的一种分析方法。
溶液中镁离子在火焰温度下变成镁原子蒸汽,由光源空心阴极镁灯辐射出镁的锐线光源经过原子蒸汽时,波长为2852埃镁特征共振线被镁原子蒸气强烈吸收,其吸收的强度与镁原子蒸气浓度的关系是符合比尔定律的,即吸光度与镁原子蒸气的基态原子数目成正比。
A=log(Ie/Ir)=kNL
式中
A——吸光度
L——(镁原子蒸气宽度)火焰宽度
Ie——镁空心阴极灯发出的光强(2852埃)
Ir——通过镁蒸气后的光强
k——吸光系数
N——镁基态原子数目
在给定的实验条件下,L是定值,N正比于溶液中镁离子的浓度C
A=kC
利用A和C的关系,用已知的不同浓度的镁离子标准溶液测出不同的吸光度,绘制成标准曲线,再测自来水中镁的吸光度,从标准曲线上求出自来水中镁的含量。
三. 仪器和试剂
1、3510型原子吸收分光光度计一台;
2、镁空心阴极灯一只;
3、容量瓶:50ml7只,100ml1只;
4、吸量管:1ml,5ml各2支;
5、塑料杯,50ml8只;
6、镁标准溶液;
称取4.1814克MgCl2.6H2O(优级纯)溶于水中移入500ml容量瓶中,用去离子水稀释至刻度,摇匀,即成1000mg/ml的镁标准溶液(储备溶液);
移取上述储备液1ml 于100ml容量瓶中,用去离子水稀释至刻度,即成10mg/ml的镁标准溶液,需实验前新配制。
7、锶溶液(干扰抑制剂)
称取优级纯SrCl2.6H2O30.4克溶于去离子水中配成100ml溶液;
四. 实验步骤
A、 溶液的制备与测定
1、标准系列的配制及标准曲线的绘制
用浓度为10mg/ml的镁标准溶液配制,分别吸取标准液0.0、1.0、2.0、3.0、4.0、5.0ml于50ml容量瓶中,每瓶中加入1ml锶溶液,用去离子水稀释至刻度,此时各个容量瓶中镁含量为0.0、10、20、30、40、50微克。依次测定各瓶溶液的吸光度,记录各瓶溶液镁含量。以吸光度为纵坐标,镁含量为横坐标绘制标准曲线。
2、自来水取样及测定镁含量
在水龙头流出强急水流5分钟后取样,用吸量管吸取自来水5ml放入50ml容量瓶中,加入1ml锶溶液,用去离子水稀释至刻度,摇匀。在绘制标准曲线相同条件下测出上面配制的自来水试样溶液的吸光度,从标准曲线求出自来水中镁含量。
B、 仪器操作步骤
1、装灯:先把灯装上1插座(装时应注意灯上缺口位置),然后把灯装上灯架;
2、打开主机电源,微机自检初始化,主显示出现“AA3510”,稍等片刻,显示“PASS1”,
然后显示“PASS2”后再显示波长为“190.0”,能量显示为“00”,主显示显示吸光度,且连续灯亮、原子吸收灯亮、吸光度灯亮。
3、积分时间为2秒,按下[2]和[时间]健;
4、设定灯1电流为2mA,按下[2]和[灯1]键。
5、设定负高压为210V,按下[2][1][0]和[增益]键。
6、设定波长为324.7nm,按下[3][2][4][.][7]和[波长]键,波长变化到324.7nm,然后从324.2开始到325.2扫描,找出能量的峰值信号。若能量显示EE,则可降低负高压(输入数字,按[增益]键);若能量显示接近“00”,则可提高灯电流,增加负高压,直至能量显示在76~89之间。
7、细调波长,按下[波长]键,则波长从324.2开始到325.2扫描,找出能量的峰值信号,若能量显示EE,则可降低负高压(输入数字,按[增益]键,重复步骤7)。直至能量显示范围在76~89之间。
8、旋转元素灯和调节元素灯架旋钮,使能量显示最大。
9、按下[增益]键,进行调零,可反复此步,直到显示为0.000。
C、 测量条件参考值
1、镁灵敏线2852埃
2、灯电流2mA
3、狭缝2档
4、空压机3.3~3.4公斤(不超过3.5公斤)
5、乙炔钢瓶总表14公斤,减压阀表0.8公斤(不超过0.9公斤)
6、乙炔气压阀旋钮调节乙炔稳定压力0.5公斤(乙炔表指示)
7、乙炔转子流量计0.7~0.8升/分,空气转子流量计5.5升/分
五. 思考题
1、原子吸收分光光度法与可见光的分光光度法有哪些相同的地方?哪些不同的地方?
2、为什么原子吸收分光光度分析中,配制和稀释溶液都要用去离子水?连续测定几个 试样为什么每次都要用去离子水调零?若忽略这一操作,将产生什么结果?

